过氧化氢分子结构及制取氧气的实验方法
纯过氧化氢是淡蓝色的粘稠液体,熔点-0.43 °C,沸点150.2 °C。凝固点时固体密度为1.71g/cm3,密度随温度升高而减小。它的缔合程度比H2O大,所以它的介电常数和沸点比水高。纯过氧化氢比较稳定,若加热到153 °C便猛烈的分解为水和氧气。
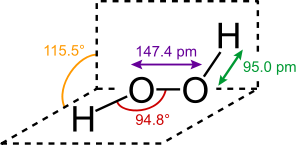
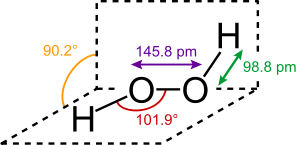
过氧化氢分子为椅型结构,见下图。左图为气态时的结构,右图为固态晶体时的结构:
过氧化氢可溶于乙醇、乙醚,不溶于苯。对有机物有很强的氧化作用,一般作为氧化剂使用。
久置于实验室的过氧化氢溶液会变质,其原因就是过氧化氢会分解成水和氧气,在常温下过氧化氢就会分解放出氧气,但是速度非常非常慢,肉眼是看不见的,为了加速反应的进行,可以采取加热的方式,加热时过氧化氢会比较快的分解出氧气(“比较快”是和常温下比较),但是与此同时,大量的水蒸气也会随之蒸发出来,所以这样的做法并不是很理想的实验室制备氧气的方法。但是加热确实会产生氧气的。
最理想的实验室制氧气的方法:常温下在过氧化氢溶液中加入二氧化锰,二氧化锰起催化作用,能够加速反应的进行。
我们需要您的支持与分享
相关新闻
- 没有资料